DERIFAT ASAM KARBOKSILAT
Asam karboksilat adalah senyawa organik yang memiliki gugus hidroksil yang terikat pada gugus asil. Gugus hidroksil dari asam karboksilat dapat tersubstitusi dengan gugus fungsi lain yang menghasilkan pembentukan turunan asam karboksilat. Dengan kata lain, gugus fungsi yang mengalami substitusi nukleofilik asil disebut turunan asam karboksilat. Asam karboksilat, karboksilat, ester, amida, thioester, asil fosfat, asil klorida dan anhidrida asam adalah turunan asam karboksilat seperti yang ditunjukkan di bawah ini. Gugus asil (RCO-) adalah umum pada semua turunan ini.
A. Pembentukan Derifat Asam Karboksilat
Asam karboksilat:
Asam karboksilat umumnya disintesis dari alkohol dan aldehida seperti yang ditunjukkan di bawah ini.
Pembelahan oksidatif alkena juga menghasilkan pembentukan asam karboksilat.Ester:
Reaksi Fischer adalah metode pembentukan ester yang paling sederhana. Dalam reaksi ini asam bereaksi dengan alkohol membentuk ester. Misalnya, asam etanoat bereaksi dengan etanol membentuk etiletanoat.
Amida:
Amida diproduksi oleh reaksi amonia atau amina dengan asam klorida. Misalnya, reaksi amonia dengan propanoil klorida akan menghasilkan pembentukan propanamida.
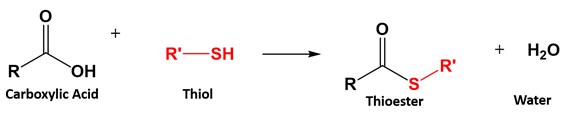
Thioester:
Asam karboksilat bereaksi dengan gugus tiol (misalnya R-SH) untuk membentuk thioester dengan pelepasan molekul air.
Asil fosfat:Anhidrida asam dibentuk oleh reaksi garam asam
karboksilat seperti natrium asetat dengan asil halida, misalnya asetil klorida
seperti yang ditunjukkan pada reaksi di bawah ini.
Salah satu sifat fisik dari asam karboksilat yaitu memiliki
titik didih yang tinggi dikarenakan ikatan hidrogen antar molekulnya. Turunan
asam karboksilat juga membentuk ikatan hidrogen dengan molekul air yang
membuatnya larut dalam air. Asam karboksilat dengan jumlah atom karbon kurang
dari sepuluh adalah cairan sedangkan asam karboksilat dengan lebih dari 10 atom
karbon berbentuk lilin seperti padatan. Mereka tidak berwarna dan memiliki bau
tertentu. Bakteri pada kulit juga menghasilkan asam karboksilat yang
menghasilkan bau. Namun, bau asam karboksilat berkurang dengan bertambahnya
jumlah atom karbon.
C. Reaksi Derifat Asam Karboksilat
Substitusi gugus
asil: Nukleofil menyerang turunan asam karboksilat dari
satu sisi karbon karbonil sehingga mengubahnya menjadi geometri tetrahedral.
Gugus X berfungsi sebagai gugus keluar dan ketika meninggalkannya, karbon
membentuk kembali ikatan rangkap dengan oksigen. Pada akhir reaksi, nukleofil
menjadi gugus X baru.
Reduksi:
Turunan asam karboksilat direduksi menjadi aldehida atau alkohol. Reaksi
reduksi meliputi dehidrogenasi katalitik, reaksi hidrida logam kompleks,
reduksi diboran, dll. Misalnya, asil halida direduksi menjadi aldehida dengan
adanya paladium sebagai katalis dalam kondisi ringan seperti yang ditunjukkan
pada reaksi di bawah ini.












Baik lah saya Nestiya Wulandari nim A1C119101 akan mencoba menjawab permasalahan pada nomor 1.
BalasHapusMenurut saya Hidrolisis suatu amida dapat berlangsung dalam suasana asam atau basa. Dalam lingkungan asam, terjadi reaksi antara air dengan amida yang telah terprotonasi dan menghasilkan asam karboksilat –NH3.
Dalam lingkungan basa, terjadi serangan OH– pada amida dan menghasilkan anion asam karboksilat +NH3.
Terimakasih.
Baiklah saya Dwi Aprilia Aji, NIM A1C119067 akan mencoba menjawab permasalahan no.2
BalasHapusSenyawa nitril memiliki titik didih yang sangat tinggi jika dibandingkan dengan senyawa – senyawa organik lain yang memiliki ukuran molekul yang sama. Bahkan senyawa nitril tidak membentuk ikatan hidrogen antar molekulnya karena pada gugus –CN tidak memiliki atom H yang dapat membentuk ikatan hidrogen dengan N. Yang membuat senyawa nitril memiliki titik didih yang tinggi adalah karena nitril merupakan senyawa yang sangat polar. Atom N adalah atom yang sangat elektronegatif sehingga dengan mudahnya menarik elektron pada ikatan ranggkap tiga ke arahnya. Akibatnya N akan bermuatan parsial negatif sedangkan C akan bermuatan parsial positif. Perhatikanlah gambar berikut yang menunjukkan dipol – dipol pada molekul nitril.
Karena memiliki kutub, senyawa nitril memiliki gaya Van der Waals berupa dipol – dipol permanen yang sangat kuat. Gaya inilah yang menyebabkan nitril memiliki titik didih yang sangat tinggi.
Terimakasih